心脏解剖:心脏传导系统和旁道
心脏解剖:心脏传导系统和旁道
一、心脏传导系统
虽然曾经有很多资料描述过连接窦房结和房室结的特殊结构—结间束,但双结之间的心肌在组织学上与上述绝缘的传导束完全不同。双结之间的心肌呈宽带状排列在大静脉开口、三尖瓣和卵圆窝周围。这些宽带(如卵圆窝边缘和界嵴)呈向心内膜表面突起的嵴状,该处心肌细胞排列整齐,与在大体标本上可见的纤维方向一致。Bachmann束及其他房间束,不论大小,均没有纤维绝缘鞘结构,也没有明确的起点和终点。在这些部位,心肌纤维方向也与传导束的长轴一致(图5.1)。

二、窦房结
窦房结的形状就像蝌蚪,有头、体和细长的尾部。在成人心脏其平均长度为13.5mm。它位于上腔静脉和右房的交界区(图5.2)。窦房结通常位于交界区前外侧的终末沟内。其头部位于心外膜下,接近终末沟的上缘,尾部向下穿入界嵴心肌,靠近心内膜下,尾部远端密度降低,分散成丛状的特殊细胞群。窦房结由大量自主神经支配,包括交感神经和迷走神经。通常有一条明显的窦房结动脉穿入窦房结。窦房结特殊的心肌细胞呈纤维网状,其外无纤维鞘包裹。
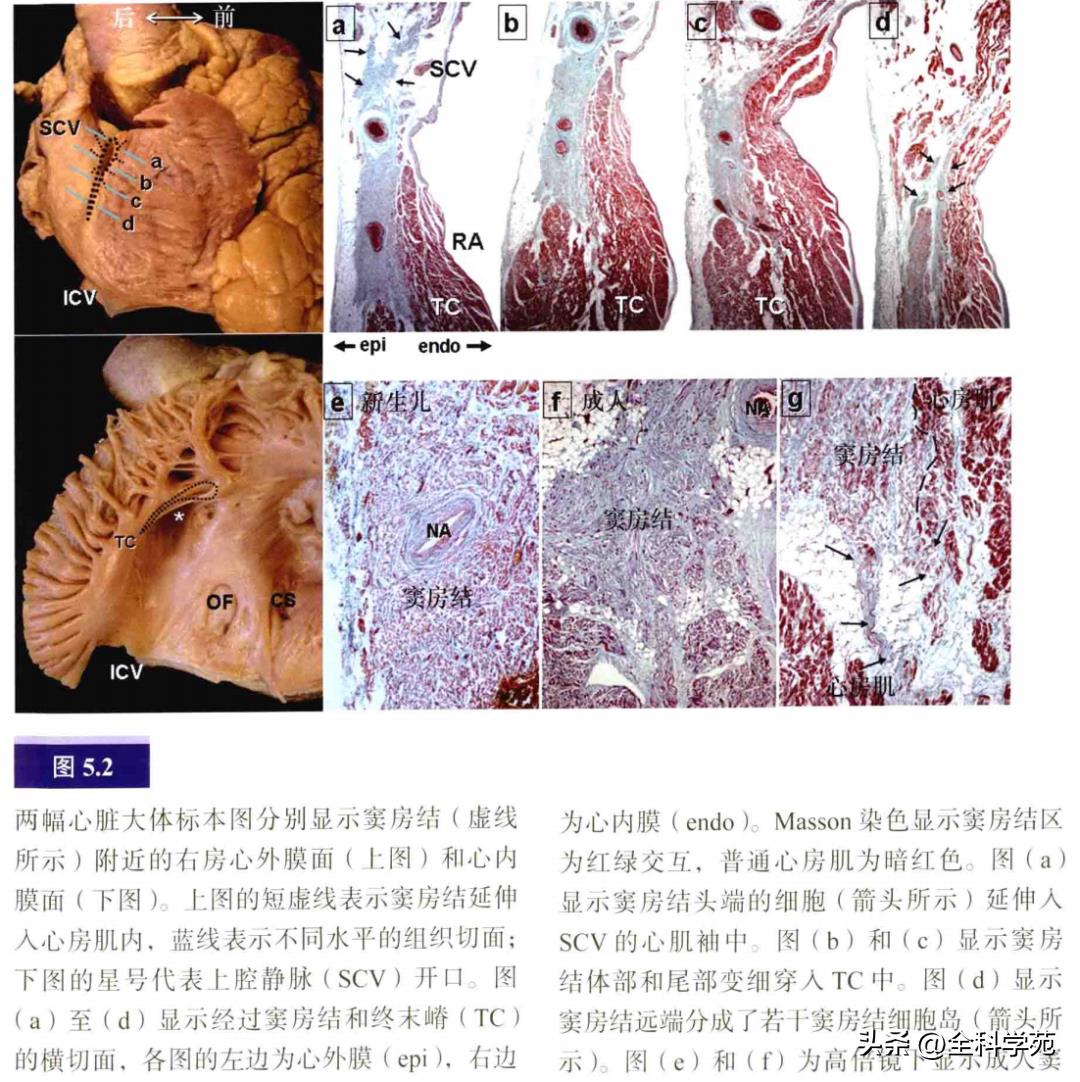
窦房结边缘通常呈不规则形,在窦房结和普通心房肌细胞间往往有交叉部分,保证窦房结至右房心肌的传导。
三、房室传导系统
正常情况下,房室之间唯一的肌性连接通道是His束。房室传导系统包括房室结、His束、共同房室束、左右束支以及往下越分越细的浦肯野纤维网(见图5.3)。纤维鞘从His束起到左右束支的范围内包裹着此传导系统(见图5.4)。位于右房的Koch三角是房室结的解剖标志。
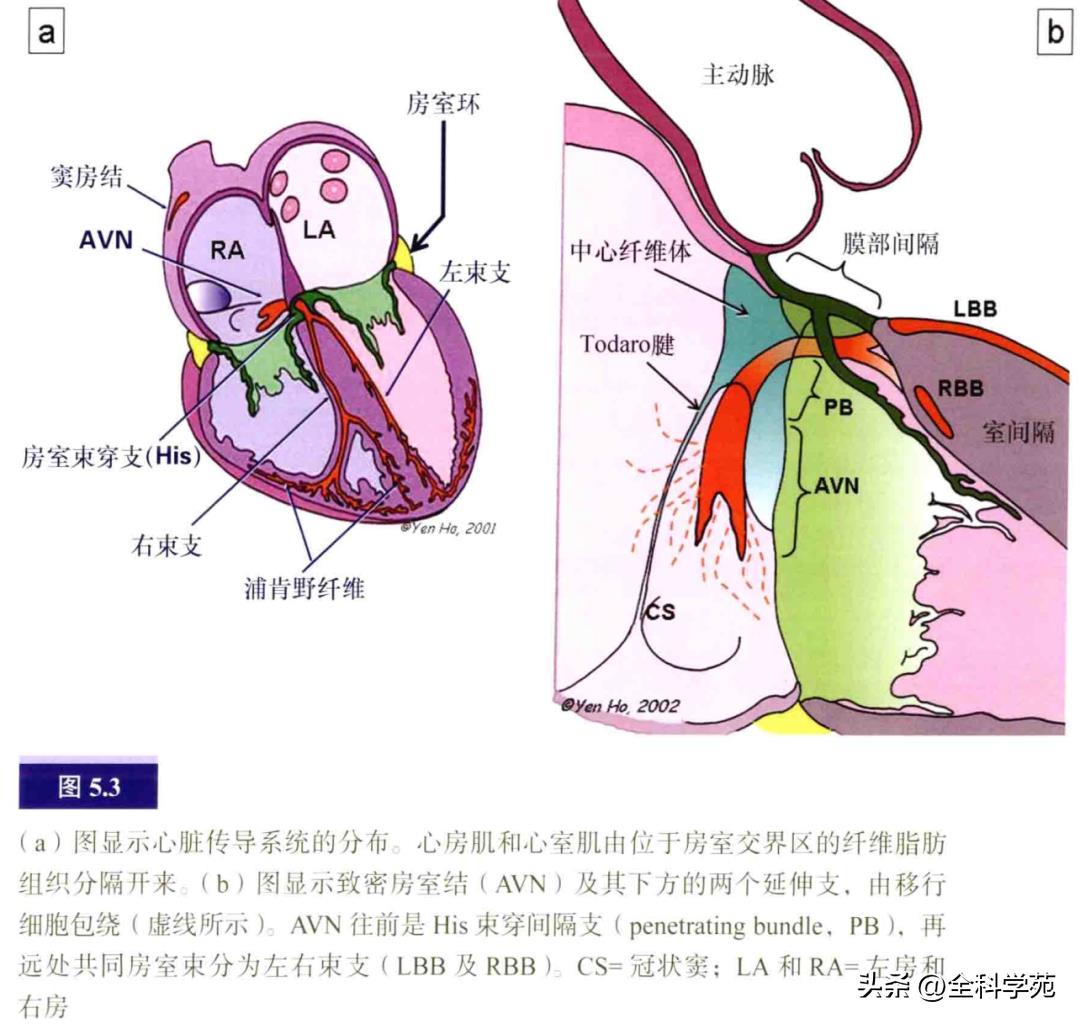
Koch三角前缘是三尖瓣隔瓣(图5.1)附着处(三尖瓣环),下缘是冠状窦口及延伸到三尖瓣的右房前庭部,后缘是一条薄的纤维带称为Todaro腱,它埋在窦间隔(欧氏嵴)心内膜下,当欧氏瓣边缘受牵拉时可呈条索状,是下腔静脉开口的标志。Todaro腱连接到位于Koch三角顶点的中心纤维体。房室结位于中心纤维体正下方,其前上方的延伸支—His束,穿过中心纤维体并由纤维组织包裹。中心纤维体的一部分向前上方延伸形成膜部间隔,后者被三尖瓣环插入分隔为房室部和室间部。在部分心脏中,膜部间隔在三尖瓣隔瓣的膜部间隔附着处有一个裂隙。三尖瓣隔瓣和前上瓣叶的交界位于间隔上方约5mm处。需要指出的是,冠状窦扩张可使Koch三角的高度降低,如合并永存左上腔静脉时。
致密房室结的形状颇像门把手,但有右下和左下延伸支(见图5.3b)。房室结主体连接着中心纤维体的心房面,所以它是双侧心房之间的结构。在成人心脏中,房室结长、宽约5mm,厚约1mm。致密房室结与右房心内膜面的最短距离约0.5~1.5mm。组织学上,致密房室结的横截面通常呈两个部分或分层,尤其在婴儿和儿童身上。常可见在深层互相交织的、具有特殊组织学特征的小型心肌细胞延伸至中心纤维体。浅层可见特殊心肌细胞如帽子般覆盖在深层细胞之外。在房室结与正常心房肌交界处,有个移行细胞区(见图5.5),这些细胞形成前支、下支和深支,抵达房室结(见图5.6)。前支始于卵圆窝前缘,止于三尖瓣前庭的普通心肌。下支始于冠状窦底部的肌性结构和欧氏嵴,止于致密房室结。深支连接致密房室结和左房前庭及卵圆窝下缘。
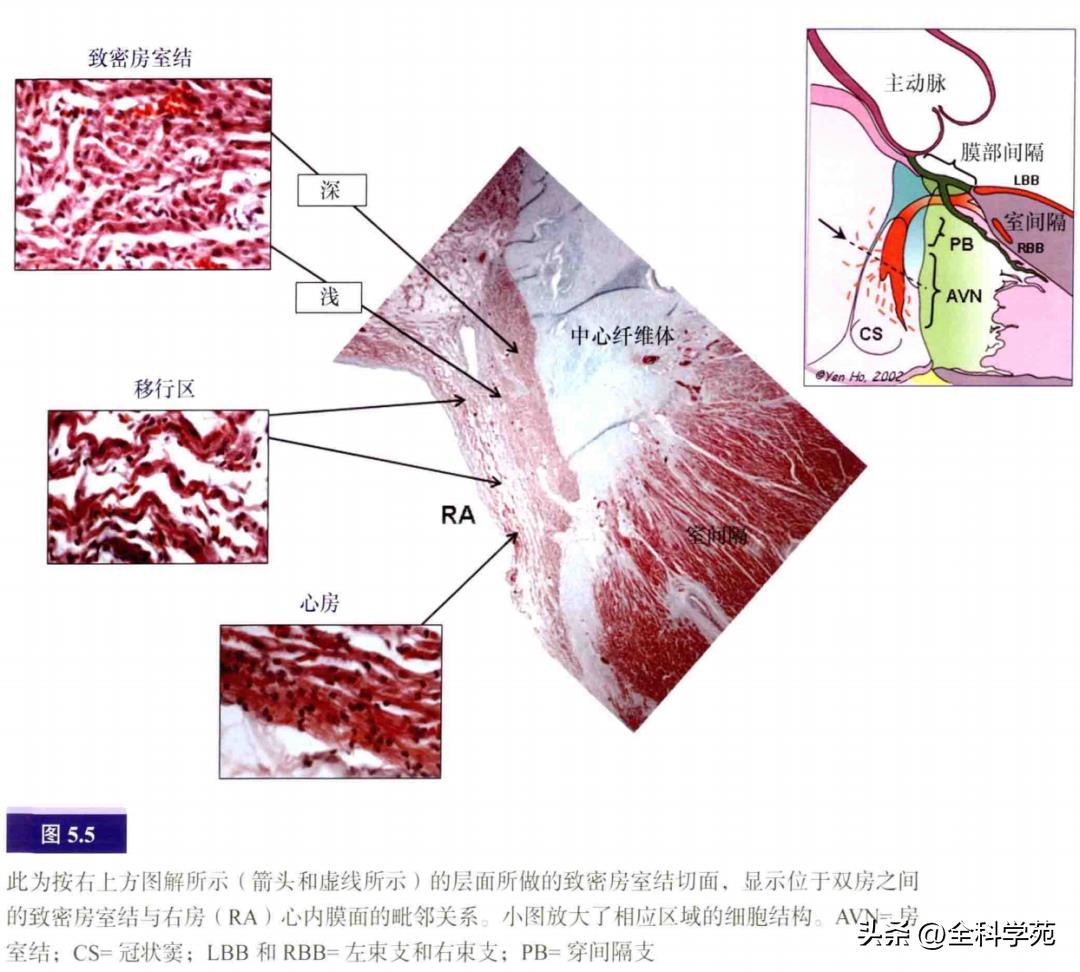
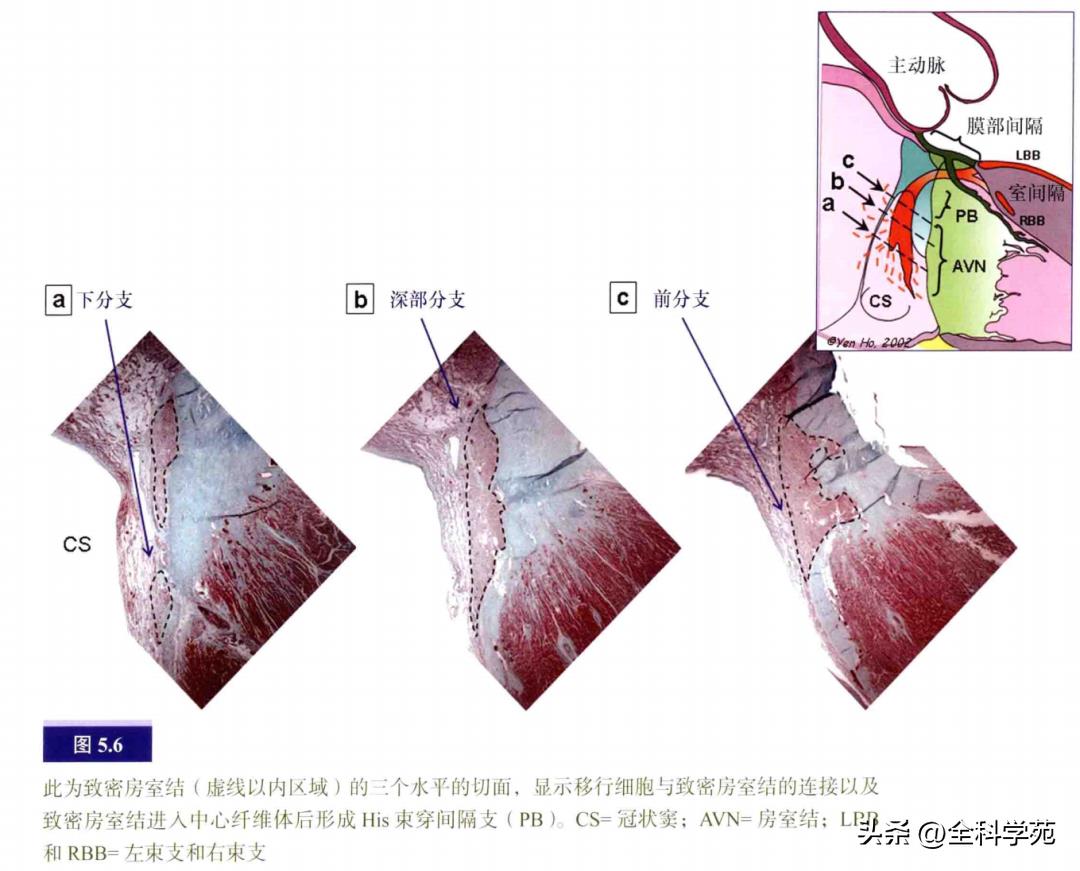
在大部分心脏,房室结动脉穿过致密房室结,而房室结下延伸支在房室结动脉的左右侧发出分支(见图5.7)。右侧延伸支平行于三尖瓣环,左侧延伸支向二尖瓣前庭投射,接近二尖瓣环。右侧延伸支位于心内膜下1~5mm,向下到达Koch三角前缘的中段,在Koch三角较小的情况下(如永存左上腔静脉伴冠状窦扩张时),甚至可达冠状窦口附近。
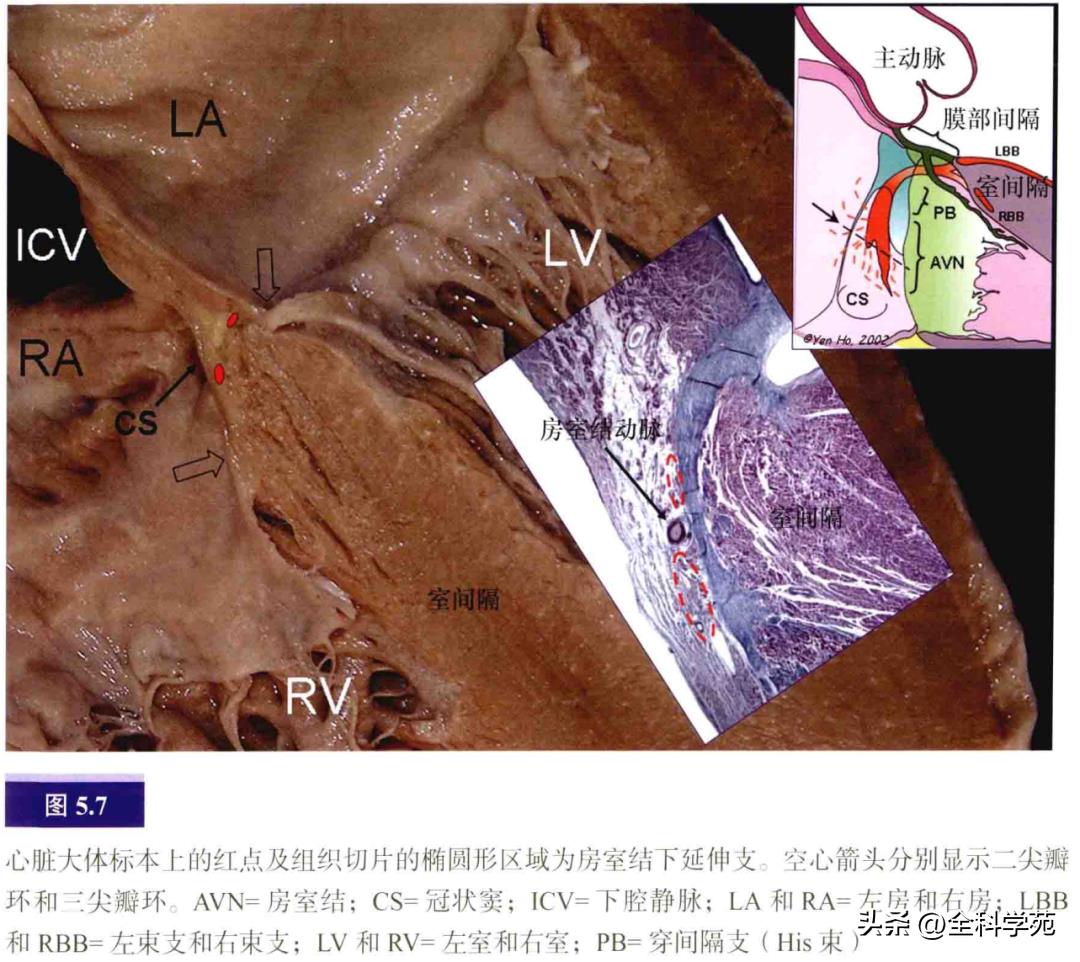
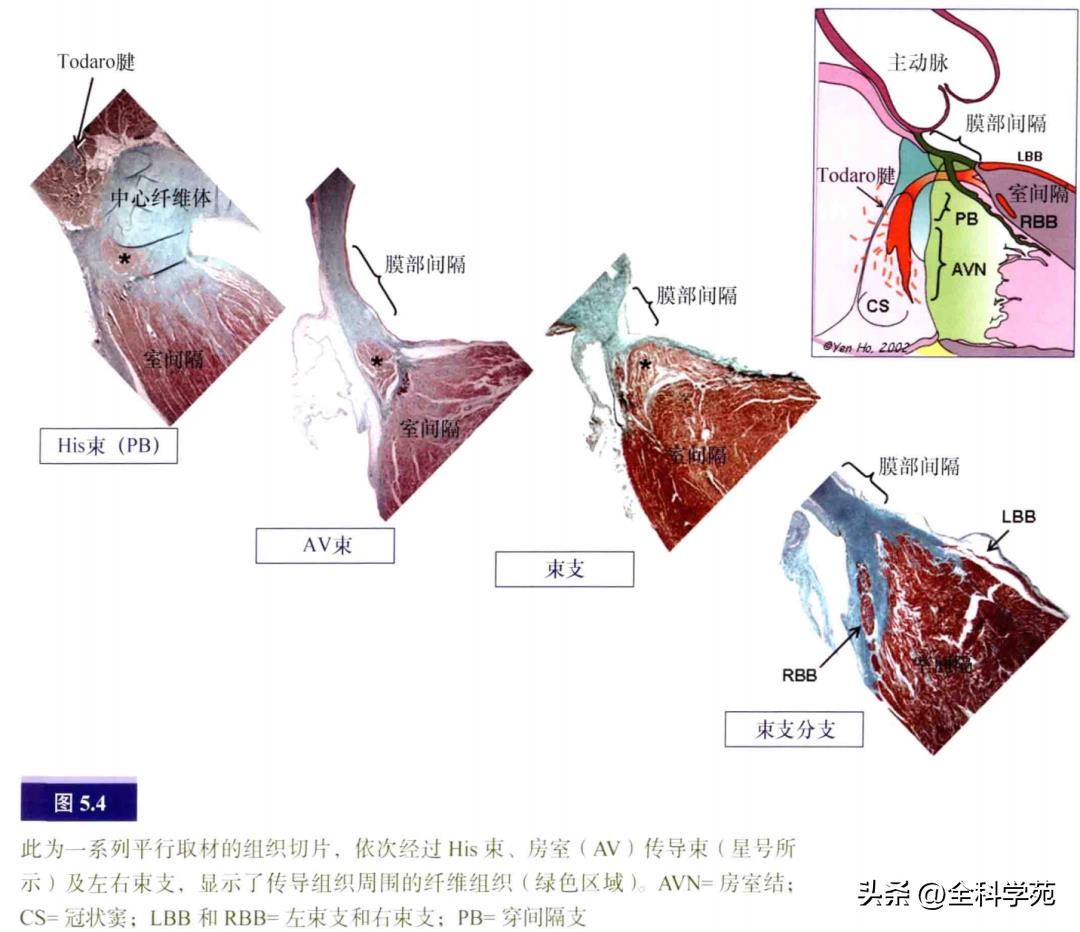
在上方的Koch三角顶点,His束向左穿过中心纤维体。这束特殊的心肌仅长1~3mm,横截面呈圆形或三角形。His束到达心室处位于膜部室间隔和主动脉流出道。房室束夹在膜部室间隔和肌性室间隔嵴部之间,偏左侧。传导束外包绕着纤维鞘,往前分为左束支和右束支(见图5.4),左束支呈扇形在左室心内膜间隔面下行并分出三个相互联系的束支。
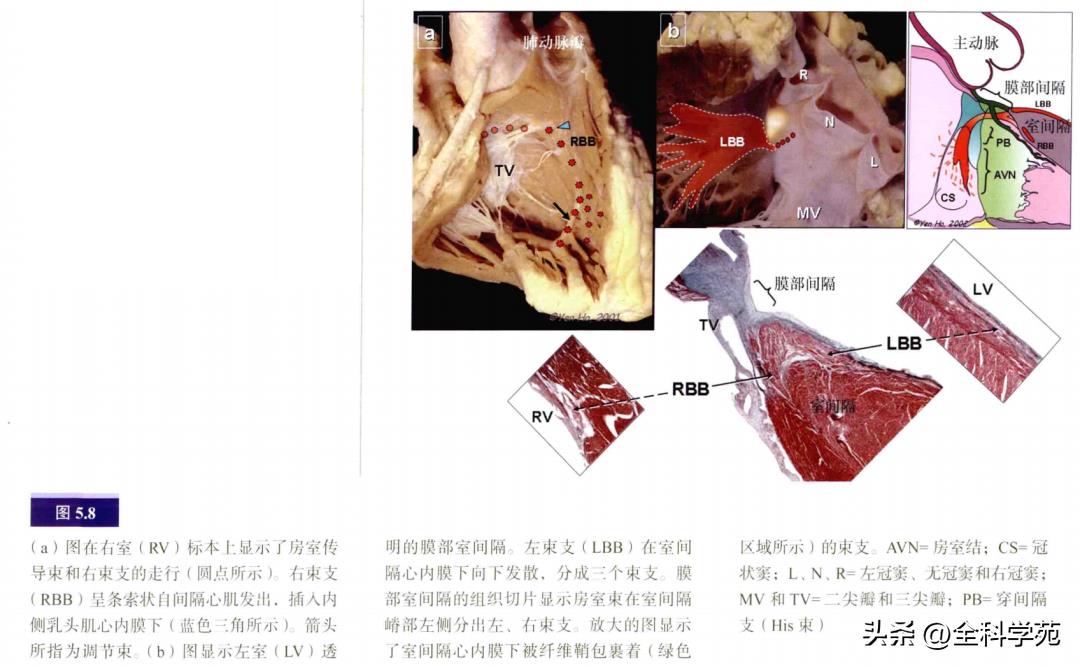
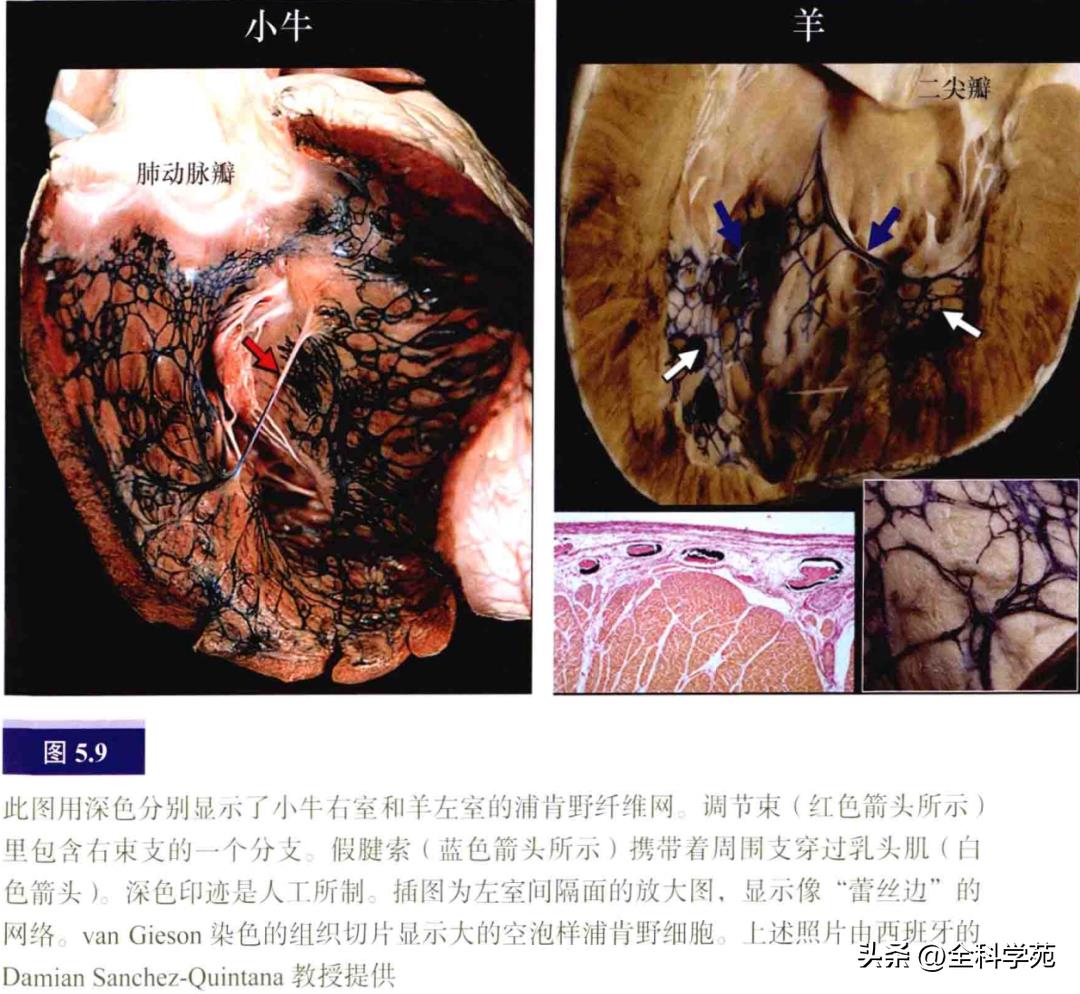
束支包裹于纤维鞘中直至远端分支。相比之下,右束支就像由特殊细胞形成的条索(见图5.4),由纤维鞘包裹,向下穿过室间隔肌部,到达内侧乳头肌基底部的心内膜下,然后走行于间隔边缘部肌小梁表浅的心内膜下。在右束支行程中,分出一分支经过调节束进入顶壁(见图5.8)。左、右束支在向下行至心尖的过程中逐渐失去纤维鞘的包裹,最后分化为外周传导网络,即浦肯野纤维。与人类心脏相比,大而呈空泡状的浦肯野细胞更常见于有蹄类动物的心脏(见图5.9)。外周传导网络的分支有时以“假腱索”的形式穿过心室到达顶壁和乳头肌。
在大多数心脏,房室结束的直接延伸支是右束支。然而,在一些心脏中,房室束本身可延伸至左、右束支分叉之后,形成终止于中心纤维体或穿过室间隔嵴抵达主动脉瓣环的第三束支(或称盲端束,见图5.10)。
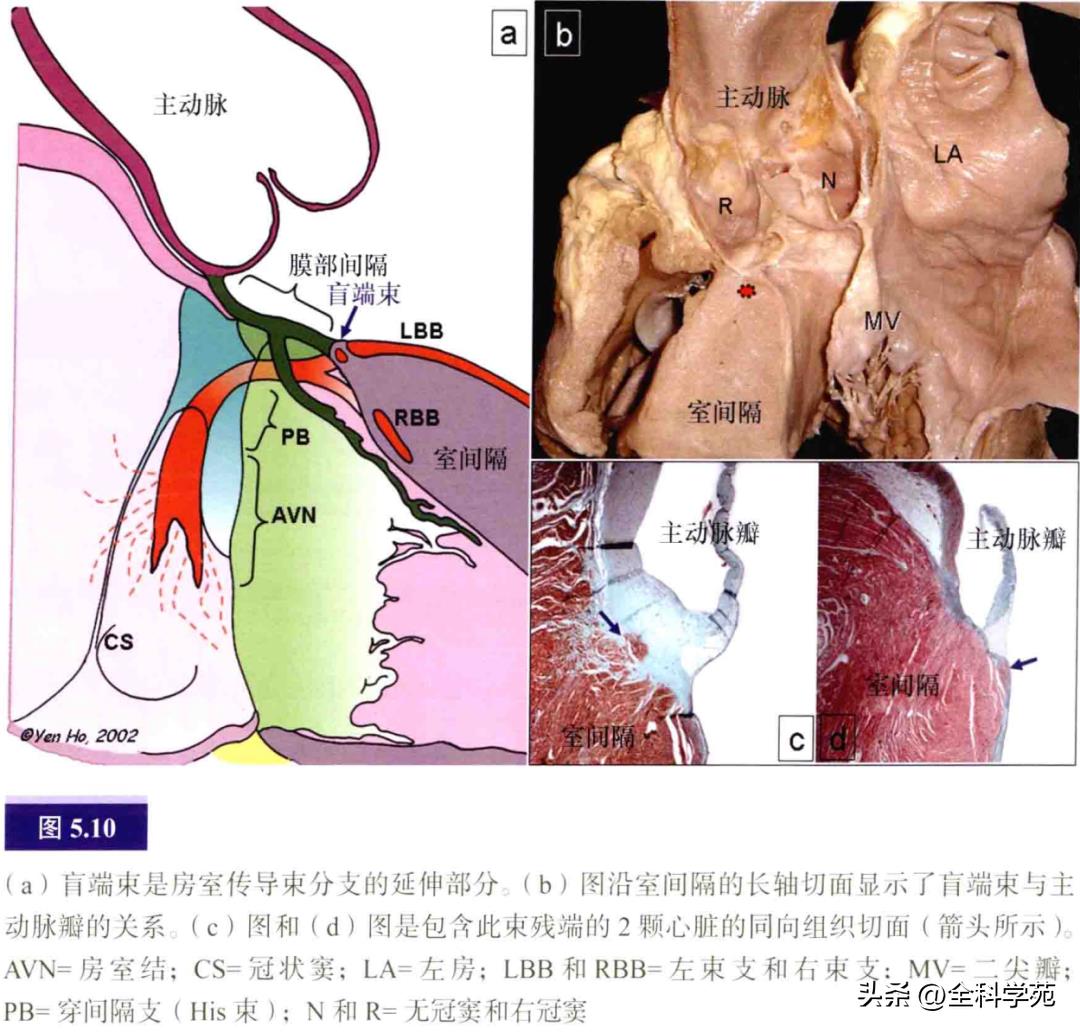
四、房室交界区
房室交界区的心房壁和心室壁是相邻的,除了房室传导组织内的His束之外,没有心肌相连。房室交界区的异常肌性房室连接可导致电传导短路,在发生前向(从心房到心室)传导时(与正常房室结传导竞争)可导致 Wolff-Parkinson-White (WPW)综合征型心室预激。
在描述旁道位置时,通常使用有倾向性的术语。真正的间隔部分局限于中心纤维体所在的区域及其周围很小的范围。所谓的前间隔靠近右室室上嵴的一部分,后间隔由与心室后壁重叠的肌性冠状窦底部和与心室肌重叠的右房前庭共同组成。在解剖上,房室交界区是左、右心腔间交界的广泛区域,此区域中间有一小块重叠的间隔成分(图5.11)。
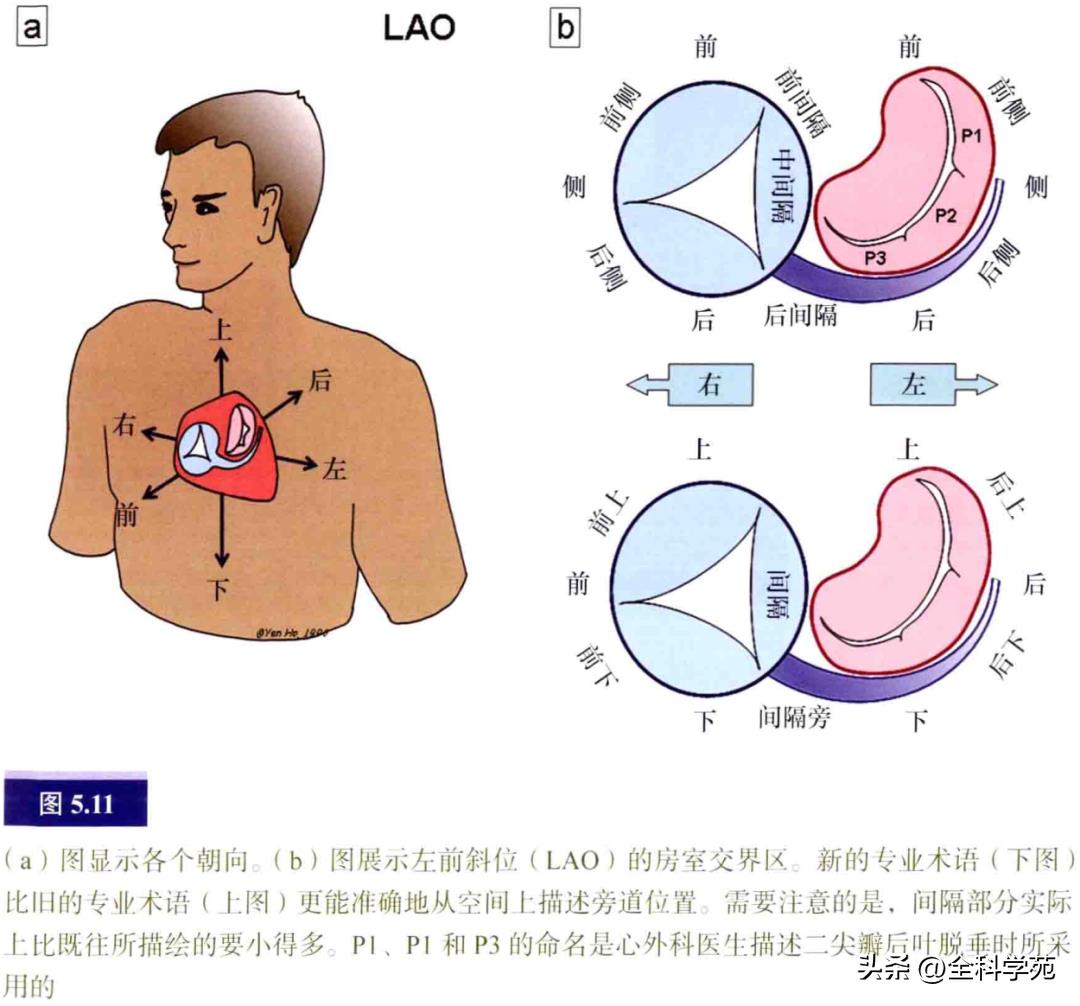
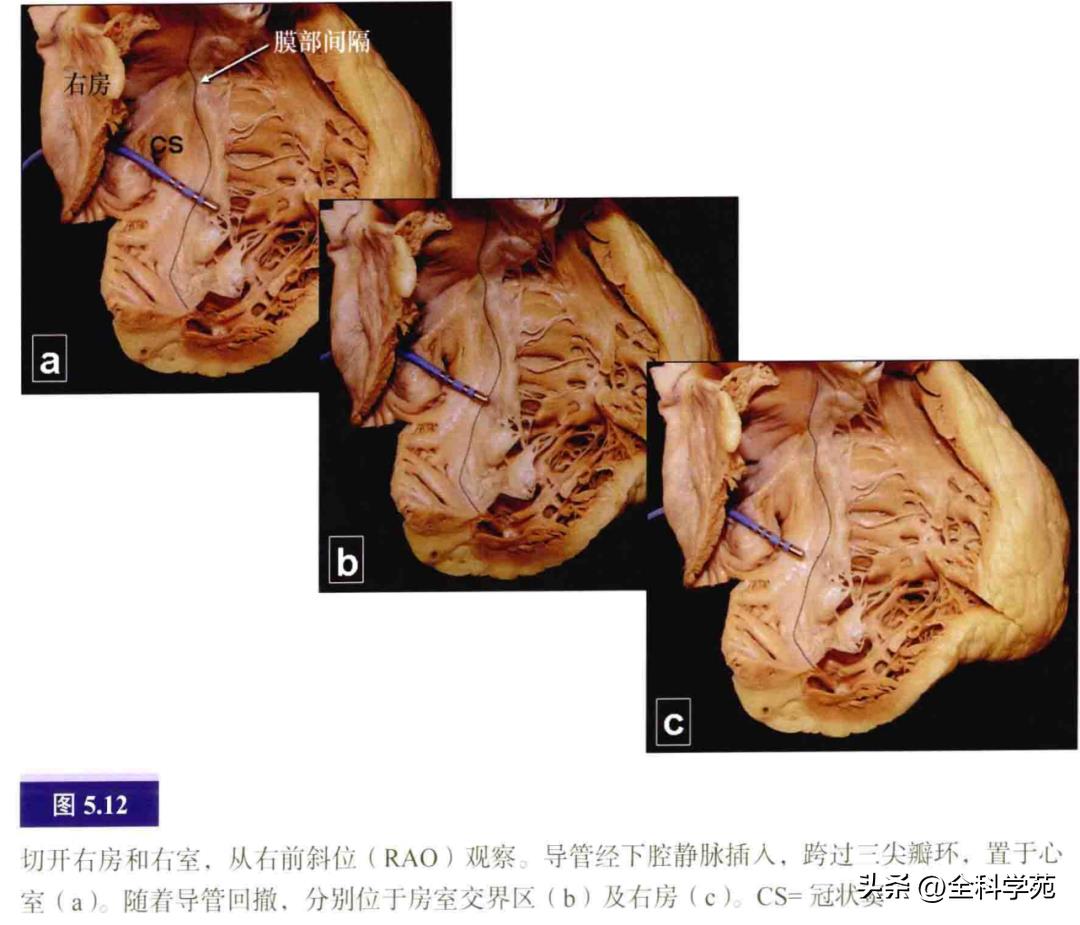
右侧房室交界区呈环形,几乎呈垂直面,其解剖标志是房室沟内的右冠状动脉。在心内膜表面,三尖瓣前庭与心室壁重叠。因此,当导管从三尖瓣环回撤时,可见大的心室电位逐渐变小,而心房电位逐渐增大(见图5.12)。位于右侧房室交界区的房室沟较左侧深。房室交界区的上方和最内侧与膜性间隔相连。
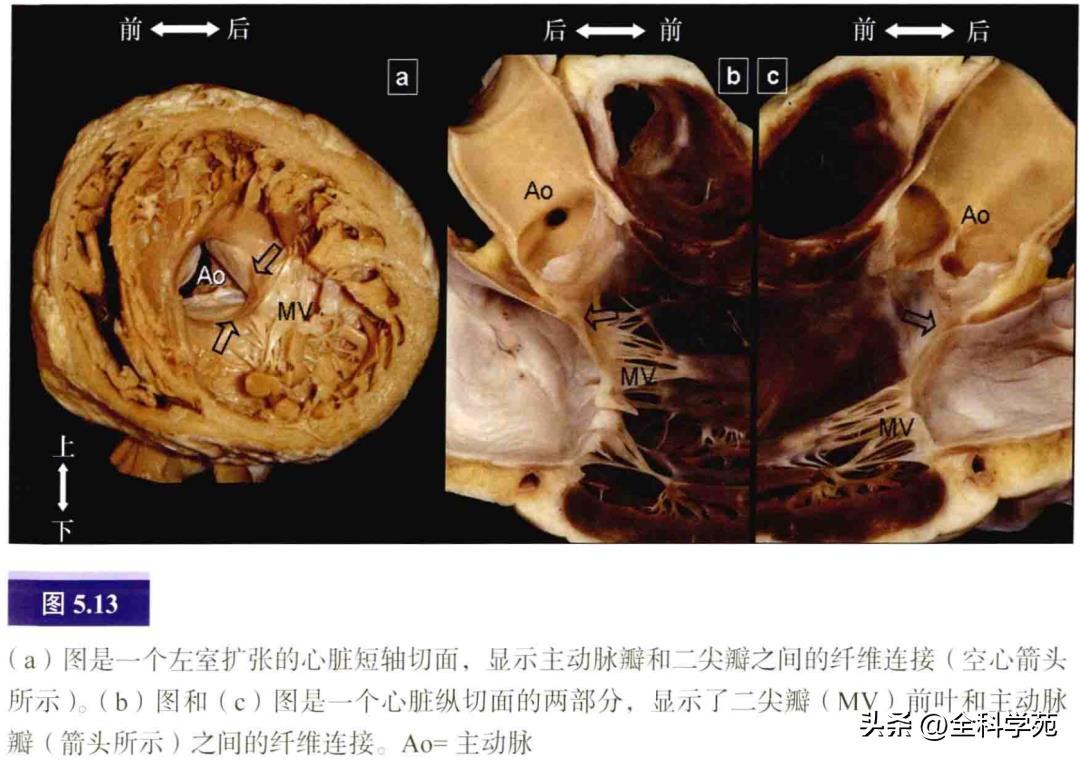
左侧房室交界区围绕着二尖瓣口,其部分区域是二尖瓣和主动脉瓣之间的纤维连接(见图5.13)。在心房侧,纤维区域与左房肌重叠,附着于二尖瓣环上。在人类心脏的心室侧,主动脉瓣和二尖瓣之间很少覆有心室肌。因此,可能存在房室旁道的部位主要局限于有二尖瓣瓣叶覆盖的房室交界区,从左前斜位看包括从前上方到后下方的范围。
左侧房室交界的下部有冠状窦及其分支—心大静脉。低位间隔旁区域,即所谓的后间隔,是含有心外膜纤维脂肪组织与房室结动脉的下三角区(图5.14)。
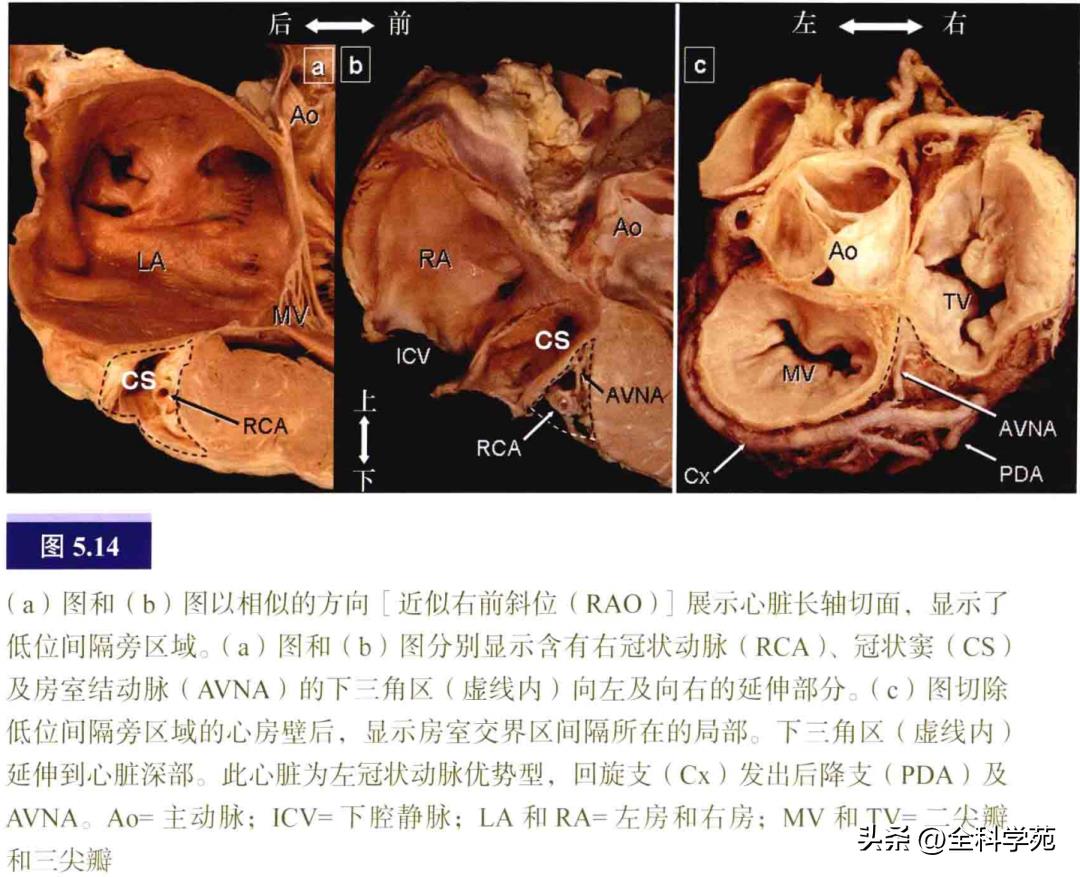
五、旁道
旁道(accessory pathways,AP)是正常房室传导组织以外的打破房室沟和瓣环绝缘性质的心肌桥(见图5.15)。旁道通常具有快速传导功能。房室旁道通常见于房室交界区的壁层,包括间隔旁区域,而很少见于主动脉瓣和二尖瓣之间的纤维连接区,因为在此区域心房肌和心室肌形成明显的裂隙,以发出主动脉流出道。旁道纤维通常呈线状,可达3mm宽,其心房插入端较宽,其心室插入端分成较细的分支。偶尔,旁道可呈10mm或更宽的带状。
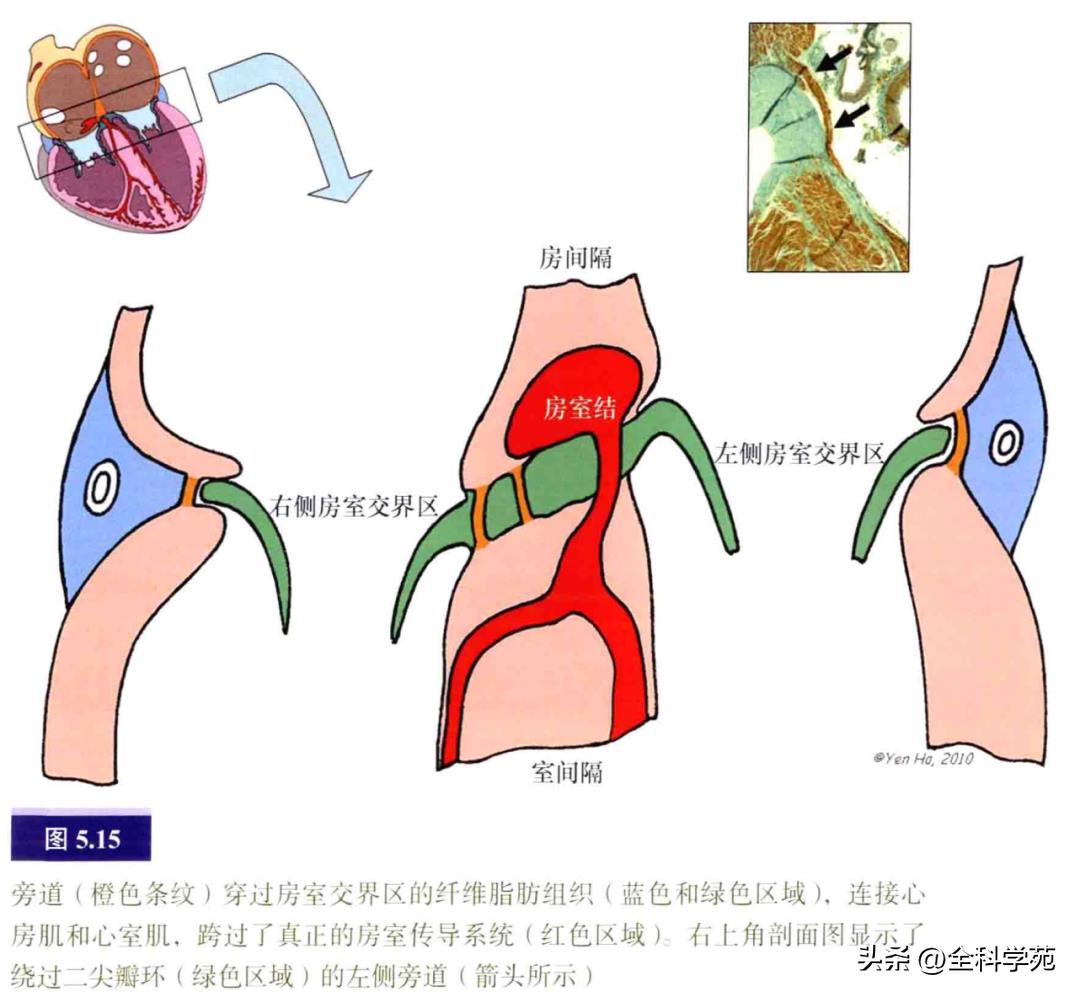
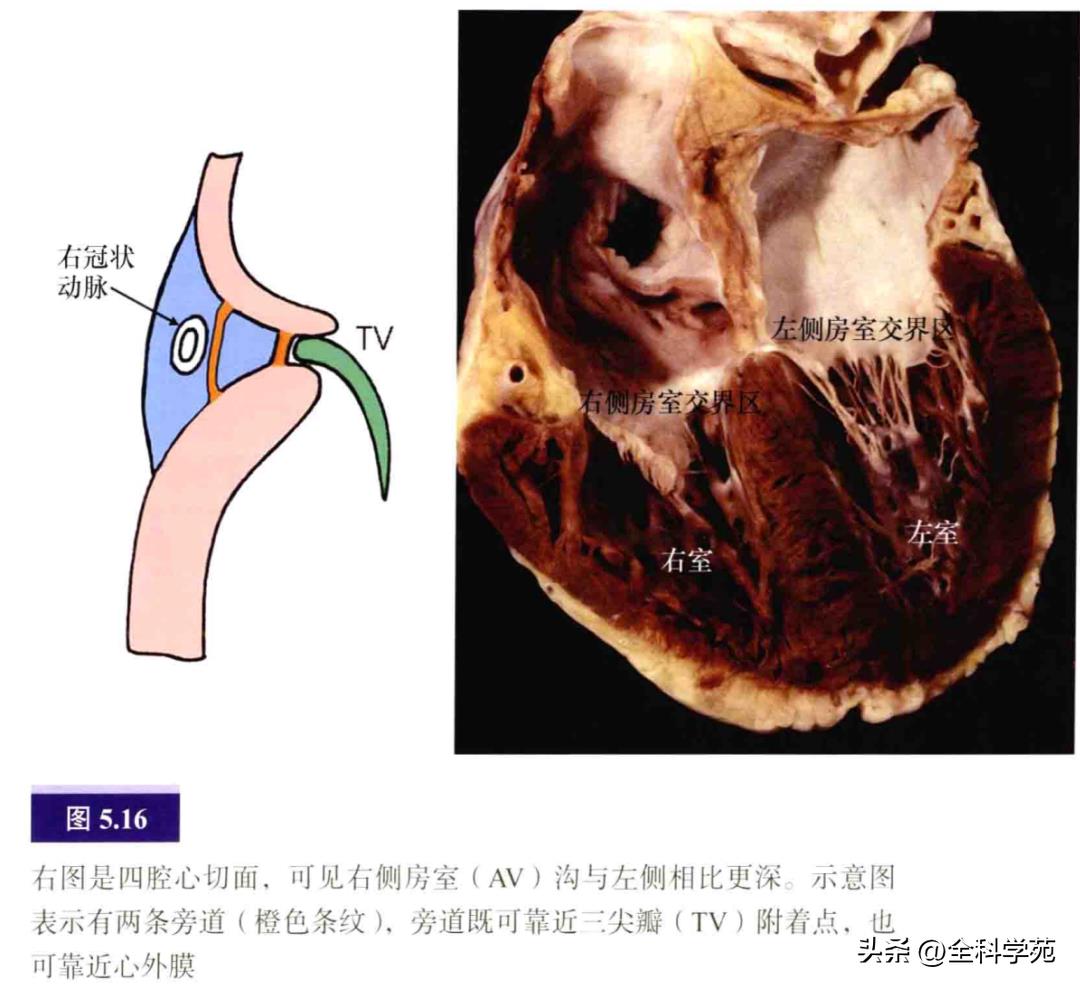
大多数AP由普通的有功能的心肌细胞组成,也曾有报道部分AP具有特殊的心肌细胞。旁道可单个存在,偶尔可多个共存。在左侧,旁道较贴近二尖瓣环。由于右侧房室沟远较左侧深,右侧旁道肌束可穿过三尖瓣环的任何深度(见图5.16)。
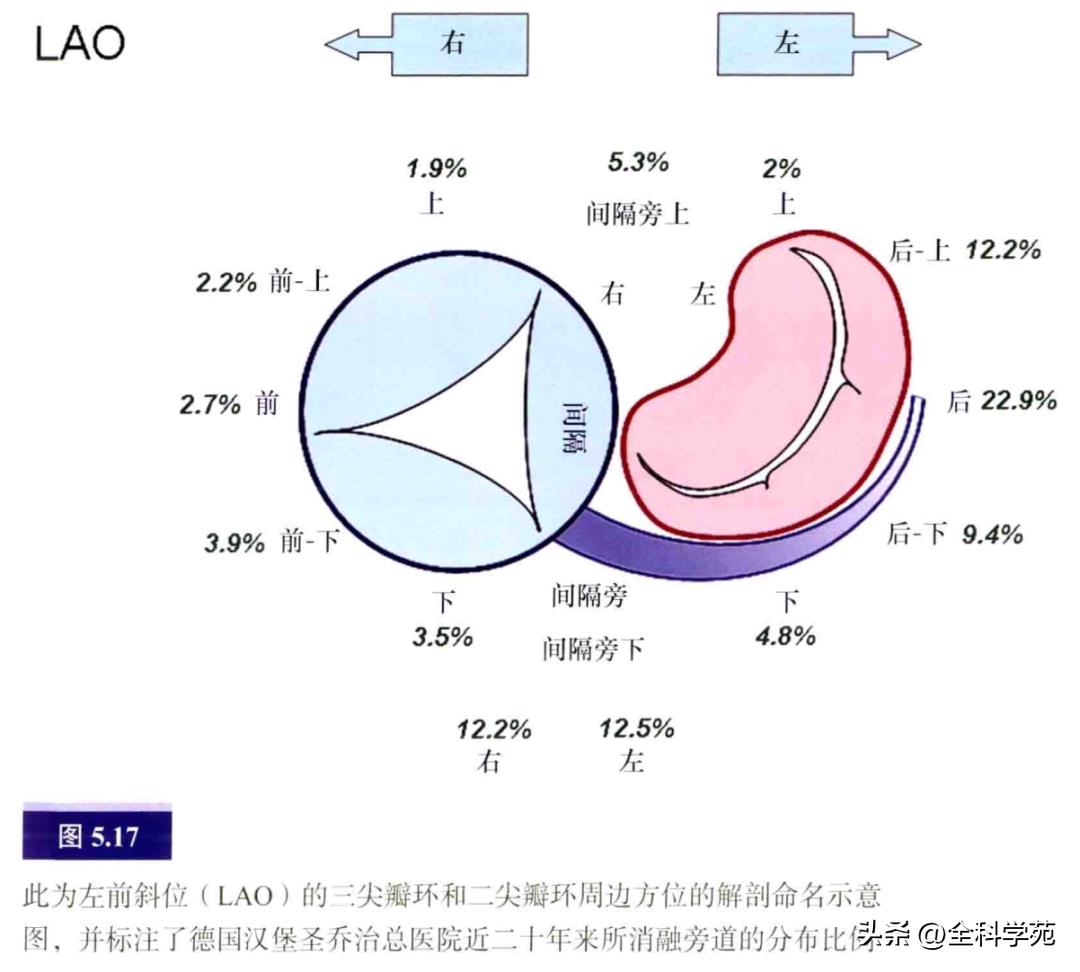
要想精确描述AP位置,必须分清房室交界区的游离壁和间隔部各处的解剖命名。多数AP位于二尖瓣环,插入点的分布差别很大。图5.17所示为某研究中心的20年经验总结。
WPW综合征通常代表旁道所致的心律失常,它代表患者的旁道具有前向传导功能(心房到心室激动),并发生阵发性心动过速。旁道前向传导所形成的δ波与旁道位置及心室预激程度有关(见图5.18)。
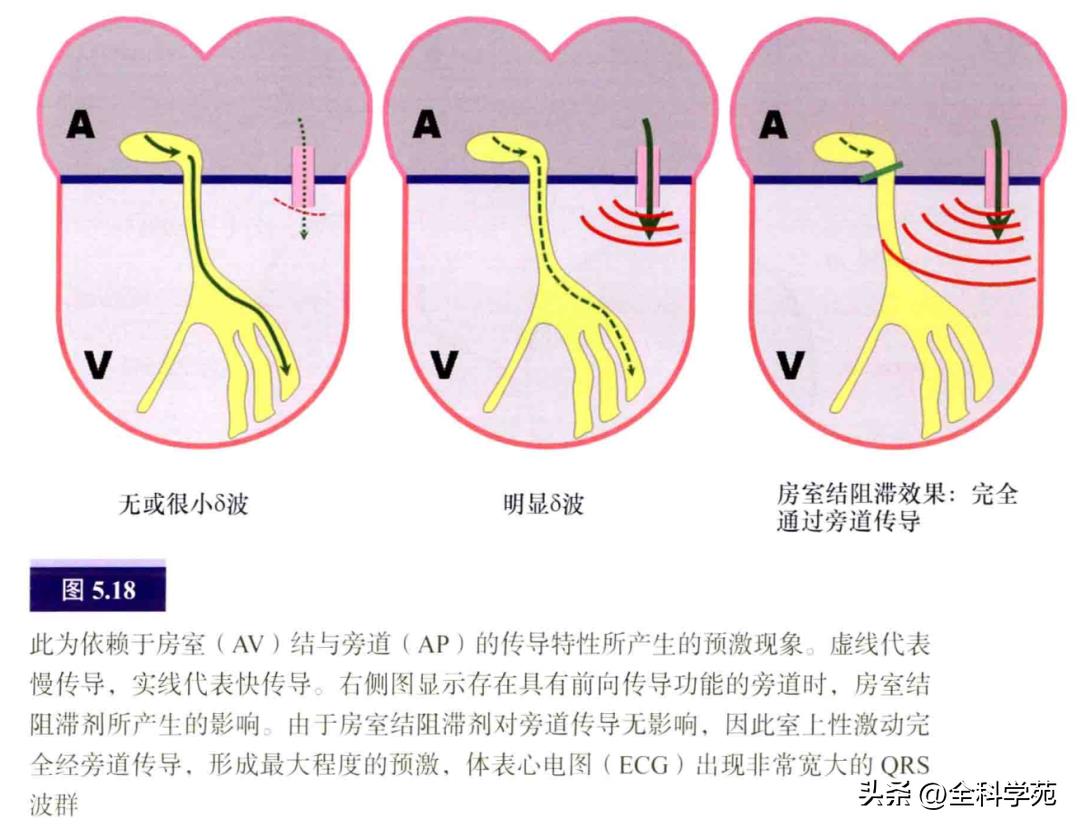
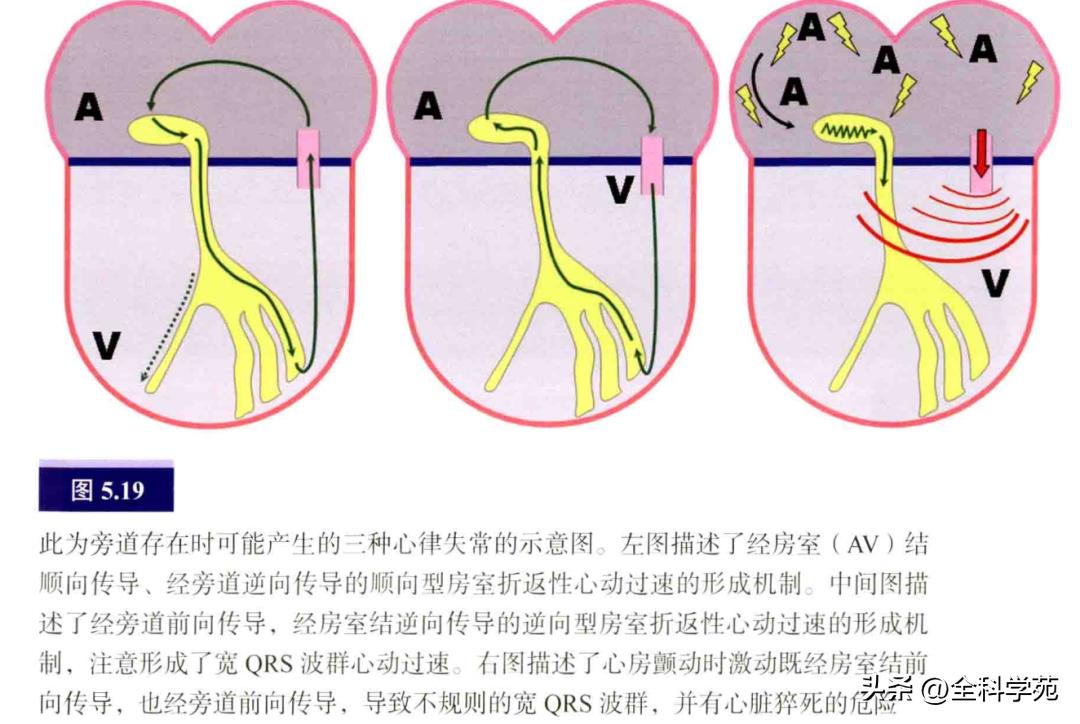
这类患者可发生宽QRS波群的逆向型房室折返性心动过速,甚至更危险的情况如预激合并心房颤动(见图5.19)。然而,实际上多数AP只有逆向传导功能(心室到心房激动),并在基线12导联心电图上看不到AP存在的证据,称为隐匿性旁道,所引起的室上性心动过速为窄QRS波群的顺向型房室折返性心动过速(房室结前向传导)。一些AP具有双向传导功能,既可产生顺向型也可产生逆向型房室折返性心动过速。
基线12导联心电图可提供具有前向传导功能的AP插入点的信息,仅有逆向传导功能的AP只能通过侵入性电生理检查来诊断。通常置于房室瓣环的诊断导管可指示AP插入点。冠状窦(CS)电极围绕着二尖瓣环,Halo导管则可置于三尖瓣环附近。还可用非常细(2~3Fr)的电极在冠状动脉(右冠状动脉或回旋支)内进行标测,标测窦性心律下心房和心室电位融合的位置(见图5.20)。在仅有逆向传导功能的AP,心室起搏(勿离可疑的AP插入点太远)可发现最早的心房激动点。同时记录His束区的激动,可鉴别房室结传导,并可于左前斜位下将其作为间隔的标志。

使用标测和消融导管进行有规律的、精细的标测,可精确定位AP插入点,例如围绕三尖瓣环(TA)标测。在准确的AP插入点上,除可标测到最早的心室/心房激动,还可标测到特殊的AP电位,此即为导管消融的靶点。固定导管,避免局部电位随心跳摆动,是保证标测和消融成功的关键。
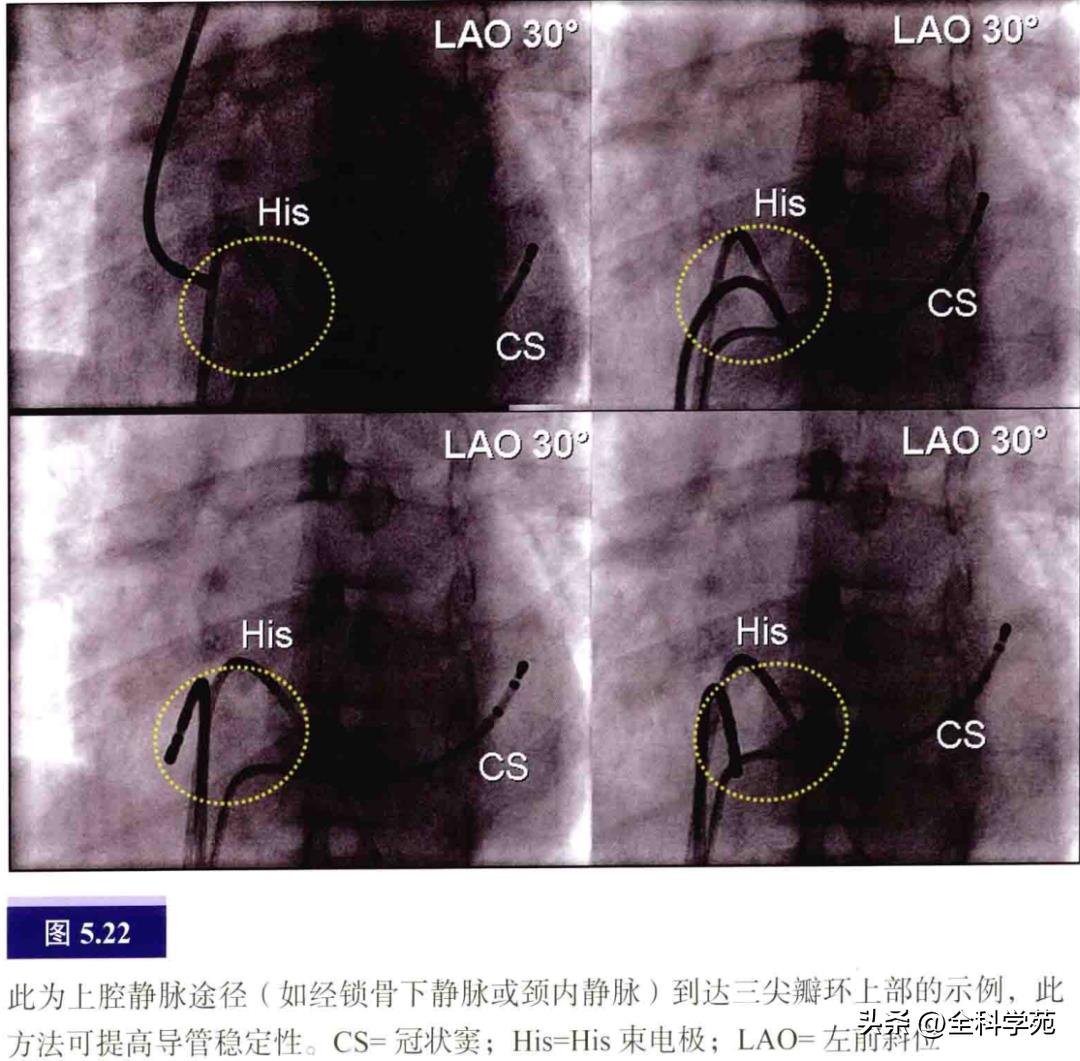
大部分TA上的AP插入点可顺利地从下位静脉(股静脉)路径到达(见图5.21),但导管在TA的上游离壁象限(TA前壁至房室交界区的上间隔旁的区域,也可称为游离壁至His束旁区域)难以固定。改为上位静脉途径如经颈静脉或锁骨下静脉可获得良好的导管稳定性(图5.22)。导管移动顺序是先到右室,然后缓慢回撤到右房,在该处较为稳定,不易发生移位。

左侧AP可通过两个途径到达,既往多数电生理医生常用逆行途径(见图5.23),但目前随着穿刺房间隔的经验丰富起来,越来越多的医生喜欢选用穿房间隔途径。
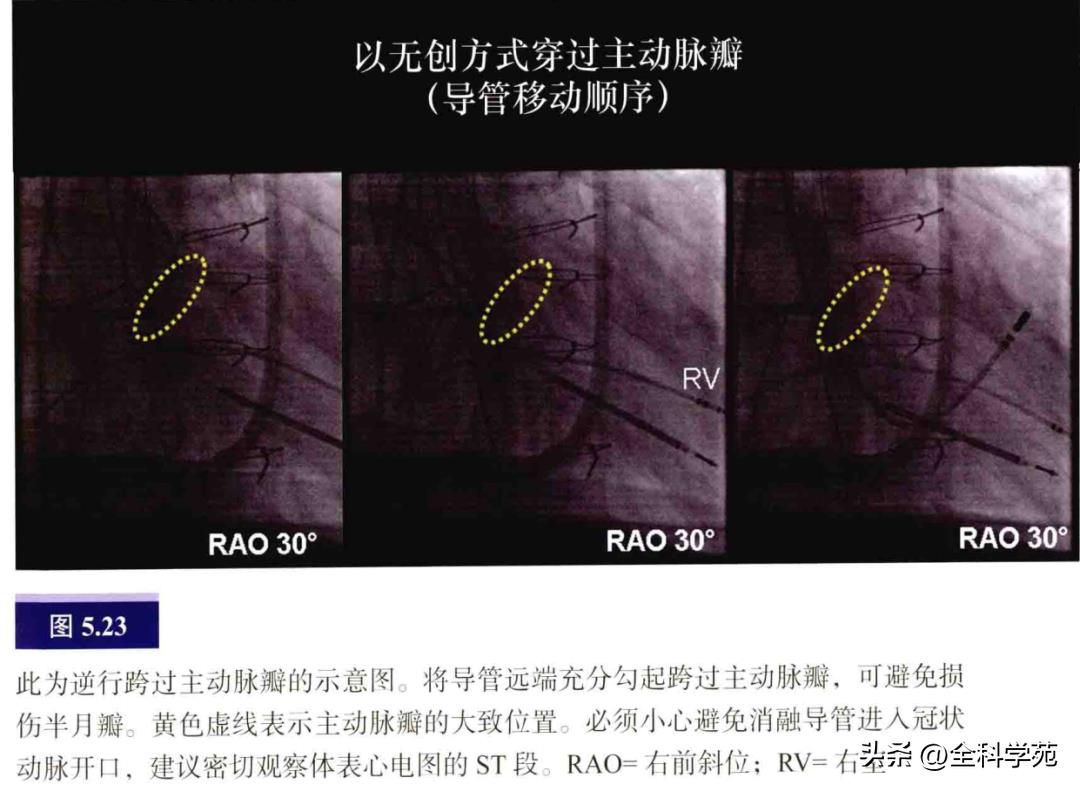
逆行法:穿刺股动脉成功后,将导管经主动脉逆行送入,在升主动脉将导管弯曲,以避免损伤的方式跨过主动脉瓣(见图5.23)。这不但可以避免损伤主动脉瓣,还可以避免阻塞或顶破冠状动脉。
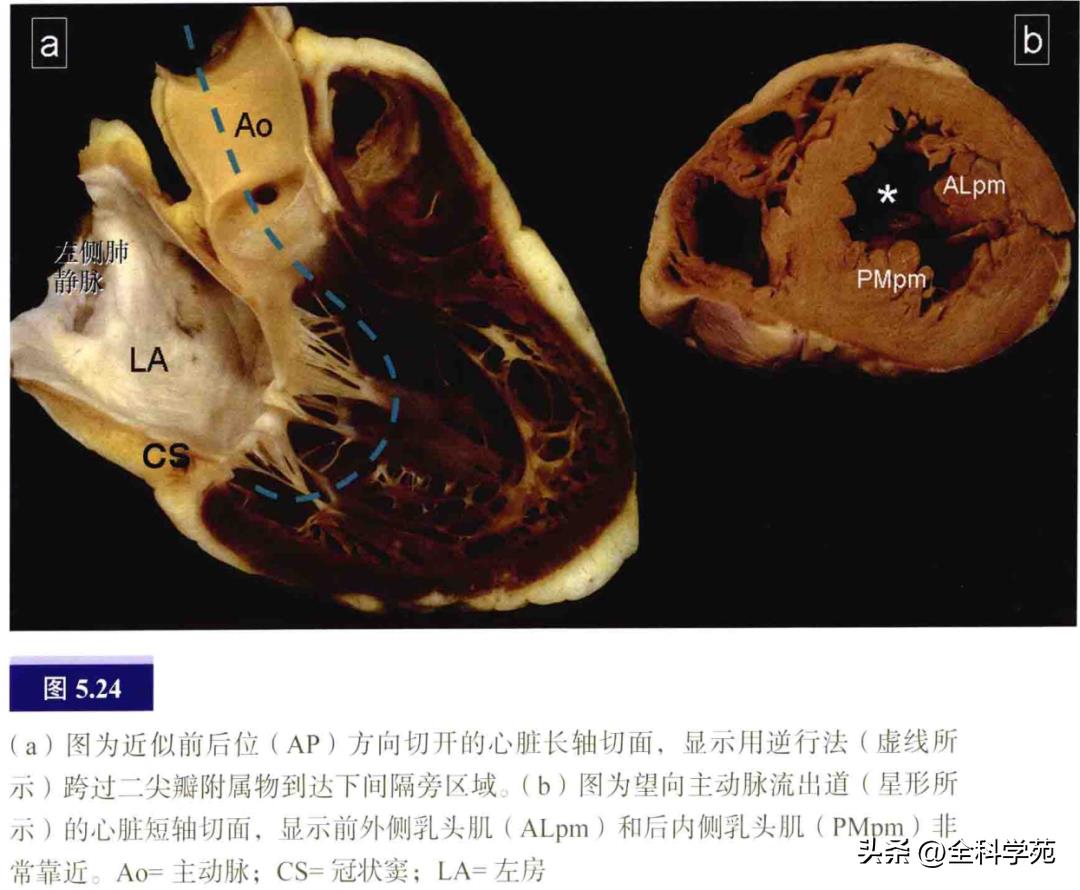
一旦跨过主动脉瓣,导管即在二尖瓣叶下方来回摆动。为了标测二尖瓣环上数个部位,必须部分回撤并重新送入导管,因为二尖瓣及其附属物阻挡了导管侧向及旋转标测(见图5.24)
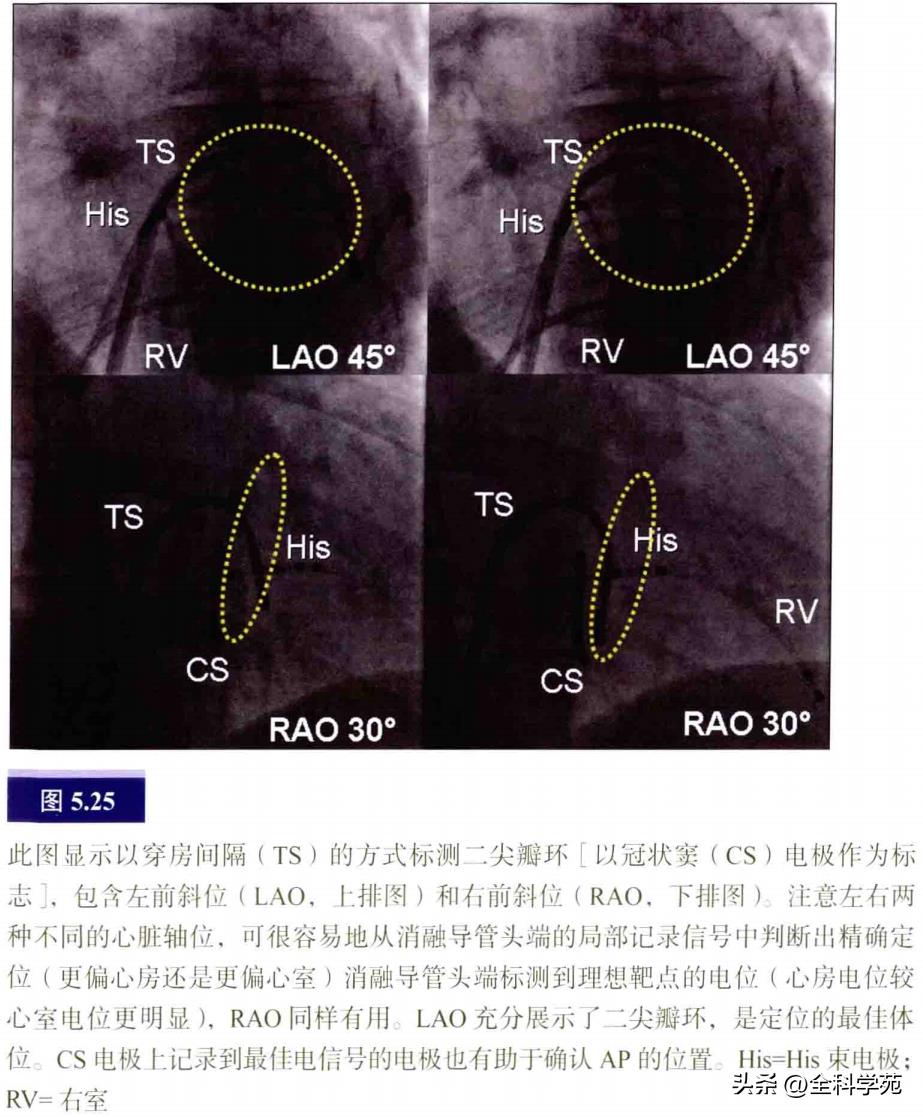
穿房间隔法标测二尖瓣环:穿刺房间隔的技巧详见第7章。由于左房心内膜面较右房光滑,穿房间隔进行二尖瓣环标测在技术上难度不大,此法可对二尖瓣环进行连续标测(见图5.25)。CS电极是AP插入点的路标,因此无论是在右前斜位还是左前斜位上进行二尖瓣环上的导管定位,它都具有良好的指引作用。导管远端平行于CS电极,并在心脏跳动时随着CS电极一起活动,而且局部电位不因心脏跳动而发生变化,则可证明导管和组织接触稳定。用此方法标测虽然方便,但最大的不利之处在于难以标测远离瓣环的心外膜AP。逆行途径有利于导管更加贴靠AP插入点。
间隔旁区域是导管消融难度较大的部位,因为常规途径有时难以固定导管,另外也有损伤位于低位间隔旁的房室结动脉和位于高位间隔旁的冠状动脉主干的风险。此外,CS瓣膜样结构等解剖变异也可增加操作困难(详见第1章)。
在CS近段放置电极间距较小的CS电极有助于标测间隔旁AP。在CS近段进行消融时使用冷盐水灌注导管可克服阻抗高的问题,但需使用较低的放电能量以避免损伤冠状动脉或导致穿孔。
虽然大部分AP直接穿过常规的房室交界区,但有一些AP呈斜向走行,少数情况下还可能在局部存在多条AP纤维。因此,术者需要留意一些少见的情况,如与CS系统相关的AP和特殊传导组织来源的AP。
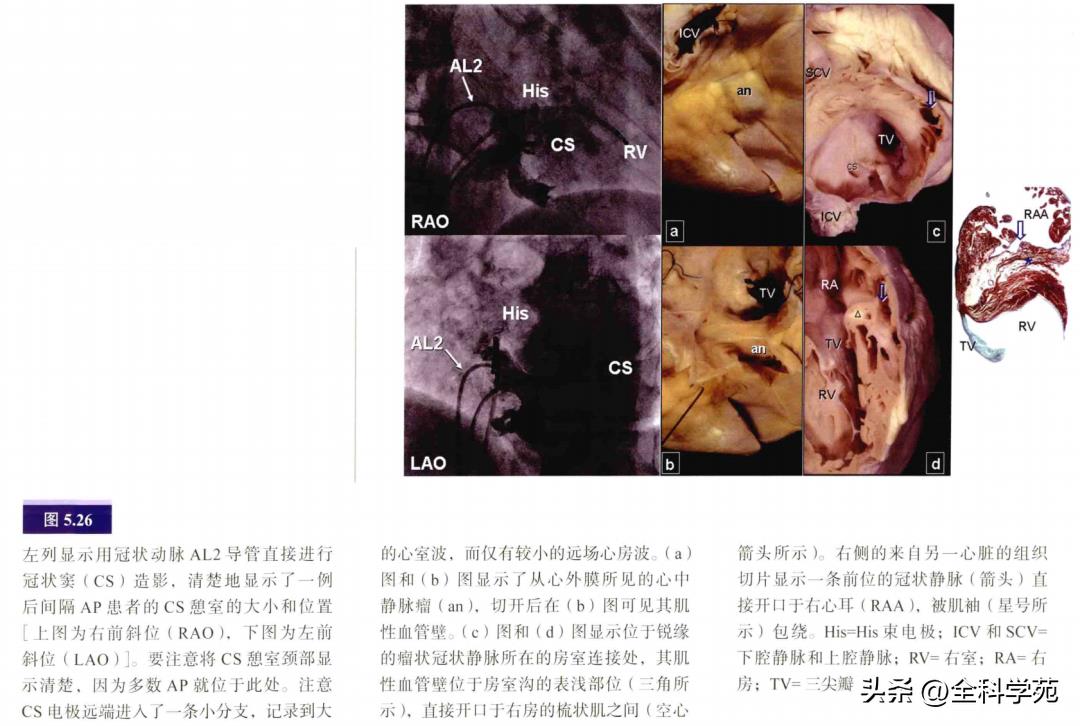
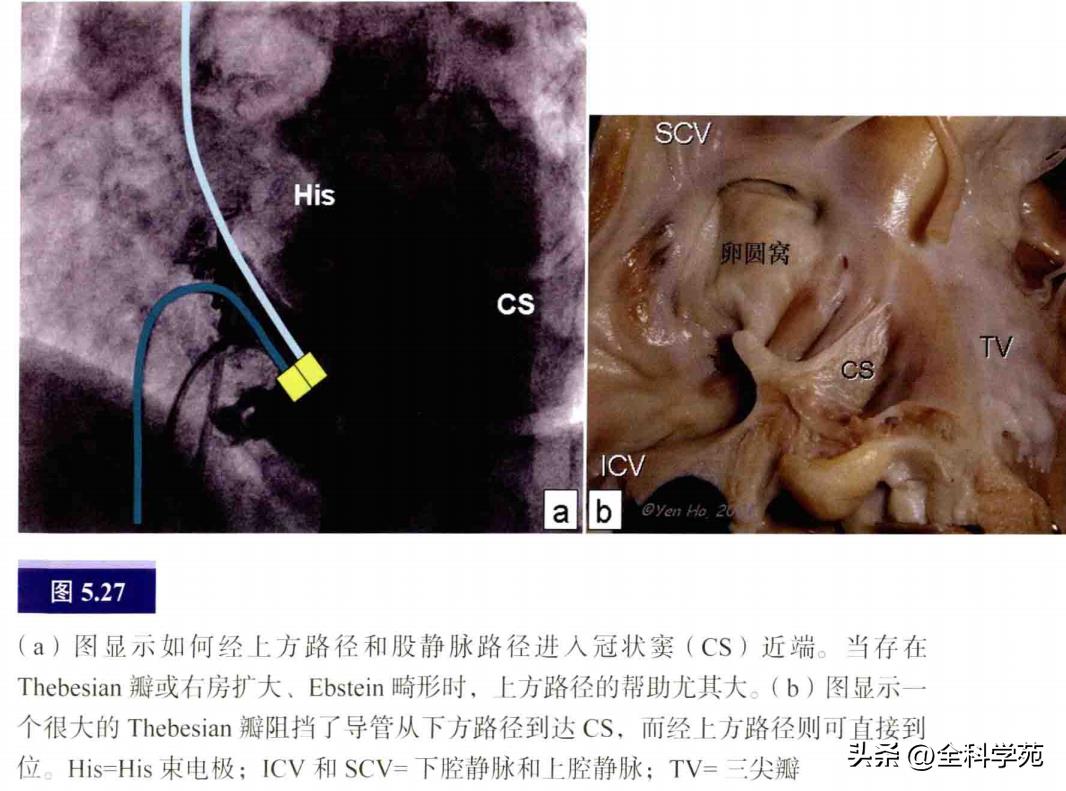
CS/静脉系统相关AP的标测:CS憩室是与AP发生相关的结构,有时冠状静脉的分支也与AP相关,此时在心房内可有扩张的静脉开口。有一些与心耳和心室重叠相关,个别病例还可能与冠状静脉隧道有关。这些AP的解剖基质是冠状静脉跨过房室交界区处存在较多的肌袖组织,或者静脉憩室的肌性静脉壁延伸至心室(见图5.26)。这些AP的消融靶点是心房面的静脉(憩室)颈部。经上方路径较易到达CS憩室颈部(见图5.27)。
多条AP的标测:消融后需仔细评估所有的电信号,尤其是心室起搏时无室房分离现象时,需留意不要忽略潜在的AP。Ebstein畸形的患者有较高的多条AP发生率,患者的三尖瓣隔瓣和后瓣向心尖下移,产生所谓的“房化右室”。与Ebstein畸形有关的内容详见第11章。
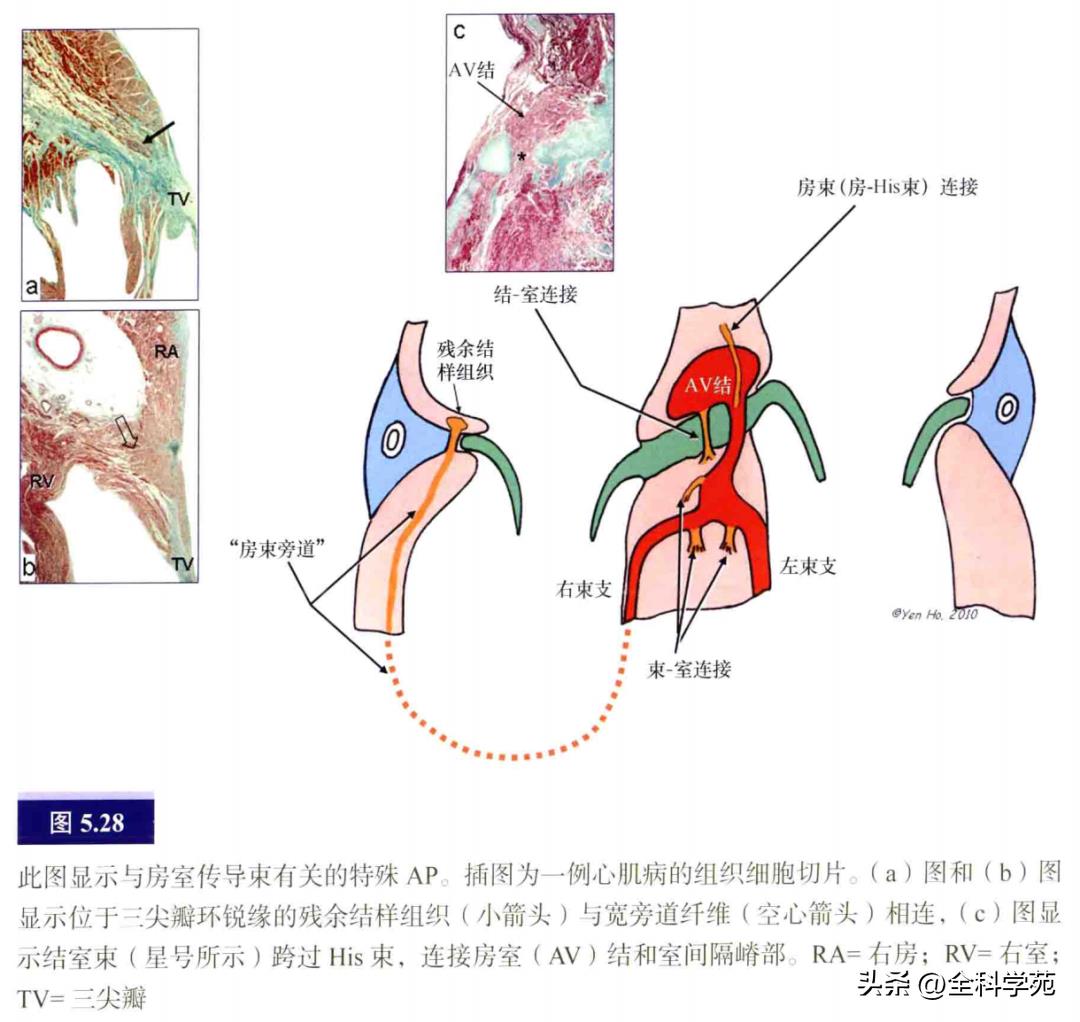
罕见AP的标测:这些AP具有与正常房室传导系统相连的肌性连接,命名根据其与特殊传导组织连接的水平而定,如房束束、结束束、结室束等(见图5.28)。房束纤维用于描述两种情况。早前用于描述直接穿过中心纤维体,连接心房和His束或共同房室传导束的纤维,也称为心房—His束AP。近年,房束束通常用于描述连接心房肌和右束支的纤维。这种纤维的特点是较长,起源于右房锐缘,有或无由特殊传导组织形成的发育不完全的结样组织,跨过房室交界区壁层,穿过心室壁层直达心尖部,在该处与穿过调节带的右束支相连。
-

- 全网必看二十部国产电视大剧
-
2024-11-04 01:57:45
-
- 0713:当你在,穿山越岭的另一边,我在孤独的路上没有尽头......
-
2024-11-04 01:55:42
-
- 金水疑云案中案-终将渡过时间的海(剑网3同人小说)
-
2024-11-04 01:53:39
-
- 宁夏“固原市”基本概述
-
2024-11-04 01:51:37
-

- 太宗皇帝知多少?
-
2024-11-04 01:49:34
-

- 十首清代黄景仁诗词,诗人生活如老杜,偶像是李白,诗风似李商隐
-
2024-11-04 01:47:31
-
- 「京城十案:北京公安史上侦破秘闻」之十八里店飞毛腿(外一篇獒兽)
-
2024-11-04 01:45:28
-

- 敢这么明目张胆地「贿赂」神明,也就中国人「小年祭灶」了
-
2024-11-04 01:43:25
-
- 湖北省荆州市基本概况
-
2024-11-04 01:41:22
-

- 人性与欲望交织最写实的农村 20部精彩农村题材电影你看了几部?
-
2024-11-04 01:39:19
-

- 2003年,钱其琛曾告诫当上外长的李肇星∶不要把官衔太当回事
-
2024-11-04 01:37:17
-

- 第二次印巴战争:1965年巴基斯坦濒临灭国,中国的帮助力挽狂澜
-
2024-11-04 01:35:14
-

- 奥巴马母亲:遭黑人骗婚3年,深耕印尼农村14年,培养出总统儿子
-
2024-11-04 01:33:11
-

- 复联4看完,总结脑海还徘徊不断的精彩情节,剧透篇,谨慎点入
-
2024-11-04 01:31:08
-

- 带着妹妹上大学,2005年《感动中国》人物洪战辉的感人事迹
-
2024-11-04 01:29:05
-
- 盘点|10部反映社会热点的现代都市剧
-
2024-11-04 01:27:02
-

- 「王者荣耀」中的三国人物
-
2024-11-04 01:25:00
-

- 演员陈数:34岁嫁2婚男,一生不要自己的孩子,当后妈也幸福
-
2024-11-04 01:22:57
-

- “体操冠军”莫慧兰:17岁就退役,拒绝美国高薪邀请,嫁富豪老公
-
2024-11-04 01:20:54
-

- 乒坛名将焦志敏:5次让球很心痛,嫁给韩国丈夫后现在怎样了?
-
2024-11-04 01:18:51



 强推古言:男主性情暴戾手段阴狠,女主战战兢兢在他手下苟且偷生
强推古言:男主性情暴戾手段阴狠,女主战战兢兢在他手下苟且偷生 国家利益高于一切
国家利益高于一切